| 项目名称:药品生产企业《药品生产质量管理规范》(GMP)的认证 | |||||
|---|---|---|---|---|---|
| 项目编码: | 220000-SY-XK-007 | 项目类别: | 行政许可 | 项目分解: | |
| 实施主体: | 吉林省食品药品监督管理局 | 承办机构: | 行政审批办公室 | 承办负责人: | 孙伟 |
| 共同实施部门: | 办理时限: | 145个工作日 | 查阅方式: | 部门网站 | |
| 咨询电话: | 82752810 | 投诉电话: | 81763355 | 是否涉密: | 否 |
| 行政职权次数: | 收费标准: | 受理费300元,审核费23000元/每个剂型,每增加一个剂型加收2300元。《关于重新核定药品生产经营企业GMP、GSP认证收费标准的函》(吉发改审批联字〔2008〕5号) | 权力变化情况: | ||
法律依据:
《中华人民共和国药品管理法实施条例》第五条 省级以上人民政府药品监督管理部门应当按照《药品生产质量管理规范》和国务院药品监督管理部门规定的实施办法和实施步骤,组织对药品生产企业的认证工作;符合《药品生产质量管理规范》的,发给认证证书。其中,生产注射剂、放射性药品和国务院药品监督管理部门规定的生物制品的药品生产企业的认证工作,由国务院药品监督管理部门负责。
权力运行图:
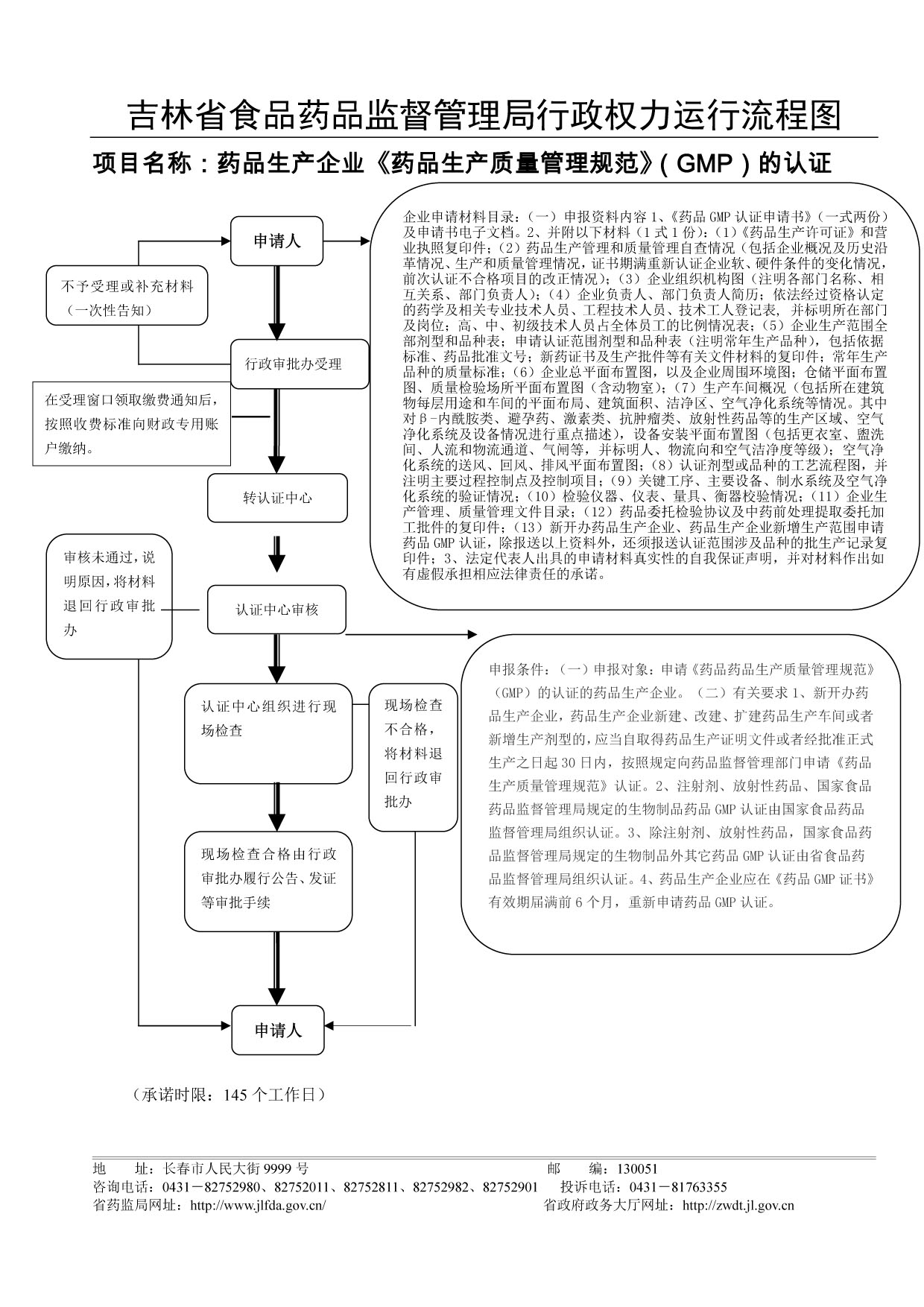 申请条件:
(一)申报对象:申请《药品药品生产质量管理规范》(GMP)的认证的药品生产企业。 (二)有关要求1、新开办药品生产企业,药品生产企业新建、改建、扩建药品生产车间或者新增生产剂型的,应当自取得药品生产证明文件或者经批准正式生产之日起30日内,按照规定向药品监督管理部门申请《药品生产质量管理规范》认证。2、注射剂、放射性药品、国家食品药品监督管理局规定的生物制品药品GMP认证由国家食品药品监督管理局组织认证。3、除注射剂、放射性药品,国家食品药品监督管理局规定的生物制品外其它药品GMP认证由省食品药品监督管理局组织认证。4、药品生产企业应在《药品GMP证书》有效期届满前6个月,重新申请药品GMP认证。 申请材料: 1、《药品GMP认证申请书》(一式两份)及申请书电子文档。 2、附以下材料(1式1份):(1)《药品生产许可证》和营业执照复印件;(2)药品生产管理和质量管理自查情况(包括企业概况及历史沿革情况、生产和质量管理情况,证书期满重新认证企业软、硬件条件的变化情况,前次认证不合格项目的改正情况);(3)企业组织机构图(注明各部门名称、相互关系、部门负责人);(4)企业负责人、部门负责人简历;依法经过资格认定的药学及相关专业技术人员、工程技术人员、技术工人登记表, 并标明所在部门及岗位;高、中、初级技术人员占全体员工的比例情况表;(5)企业生产范围全部剂型和品种表;申请认证范围剂型和品种表(注明常年生产品种),包括依据标准、药品批准文号;新药证书及生产批件等有关文件材料的复印件;常年生产品种的质量标准;(6)企业总平面布置图,以及企业周围环境图;仓储平面布置图、质量检验场所平面布置图(含动物室);(7)生产车间概况(包括所在建筑物每层用途和车间的平面布局、建筑面积、洁净区、空气净化系统等情况。其中对β-内酰胺类、避孕药、激素类、抗肿瘤类、放射性药品等的生产区域、空气净化系统及设备情况进行重点描述),设备安装平面布置图(包括更衣室、盥洗间、人流和物流通道、气闸等,并标明人、物流向和空气洁净度等级);空气净化系统的送风、回风、排风平面布置图;(8)认证剂型或品种的工艺流程图,并注明主要过程控制点及控制项目;(9)关键工序、主要设备、制水系统及空气净化系统的验证情况;(10)检验仪器、仪表、量具、衡器校验情况;(11)企业生产管理、质量管理文件目录;(12)药品委托检验协议及中药前处理提取委托加工批件的复印件;(13)新开办药品生产企业、药品生产企业新增生产范围申请药品GMP认证,除报送以上资料外,还须报送认证范围涉及品种的批生产记录复印件;3、法定代表人出具的申请材料真实性的自我保证声明,并对材料作出如有虚假承担相应法律责任的承诺。 |
|||||